Внешний консультант лаборатории - Дмитрий Михайлович Колпащиков.
Отбор генов домашнего хозяйства
Генотерапевтические агенты на основе нуклеиновых кислот широко исследуются для лечения онкологических заболеваний. Наша миссия заключается в разработке собственного уникального подхода с использованием ДНК нанотехнологий. Наша терапевтическая стратегия заключается в сайленсинге жизненно важных генов домашнего хозяйства в присутствии РНК-маркеров рака. Перед нами стоит задача найти наиболее уязвимый ген или набор генов, подавление которых приведет к апоптозу клеток. С этой целью мы создаем антисмысловые олигонуклеотиды и малые интерферирующие РНК против интересующих нас генов, и оцениваем цитотоксичность, вызванную сайленсингом генов в различных линиях раковых клеток. Наиболее перспективные и уязвимые кандидаты генов домашнего хозяйства мы используем для конструирования противоопухолевых геннотерапевтических агентов.
Выбор универсальных онкомаркеров
Мы стремимся разрабатывать безопасные и селективные генно-терапевтические агенты. Жизненно важные гены домашнего хозяйства не могут быть выключены напрямую, ведь в этом случае возникнут множественные побочные эффекты в нормальных тканях. Чтобы достичь терапевтического апоптоза избирательно в раковой клетке, мы разрабатываем ДНК-конструкции, активируемые маркером рака. Такие генотерапевтические агенты активируют терапию (сайленсинг генов) только после взаимодействия с онкомаркерами. В качестве ракового маркера мы используем микроРНК, матричные РНК с однонуклеотидным полиморфизмом и другие типы РНК. Глобальной задачей является поиск общих онкомаркеров, оверэкспрессированных в нескольких типах опухолей, для создания универсальных противораковых генно-терапевтических агентов.
Разработка ДНК-машин на основе нуклеиновых кислот с терапевтической функцией, активируемой онкомаркером
Мы разрабатываем «умные» ДНК-конструкции на основе зарекомендовавших себя геннотерапевтических технологий, подтвердивших свою эффективность в клинической практике. Наши исследования сосредоточены на технологии антисмысловых олигонуклеотидов (АСО), малых интерферирующих РНК (миРНК) и ДНКзимов. Они демонстрируют преимущества, среди которых высокая производительность, возможность нацеливания практически на любые интересующие гены, простота конструкции и разнообразие применений. Таким образом, наша задача состоит в том, чтобы объединить эти перспективные технологии с нашим передовым подходом использования генов домашнего хозяйства в качестве мишени в раковых клетках.
Наши проекты включают разработку противораковых ДНК-машин на основе ДНКзимов, Интеллектуальные системы логических вентилей для внутриклеточного компьютирования (рисунок 1), Бинарные антисмысловые агенты (рисунок 2), ДНК-машины на основе АСО, контролируемые концентрацией маркеров рака, а также ДНК-кассеты, селективно высвобождающие миРНК. На этапе разработки все конструкции проходят два этапа: оптимизацию in vitro и внутриклеточное тестирование.
Мы стремимся развивать исследования в области онкологии и закладывать основу для разработки новых препаратов для персонализированного лечения онкологических заболеваний.
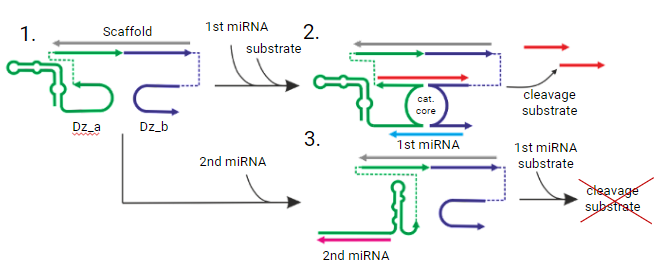
Рисунок 1. Принцип работы логических вентилей, активируемых онкомаркером (1st miRNA), для расщепления РНК субстрата (выделено красным). Онкосупрессор (2nd miRNA) ингибирует формирование каталитического кора, отменяя расщепления субстрата.
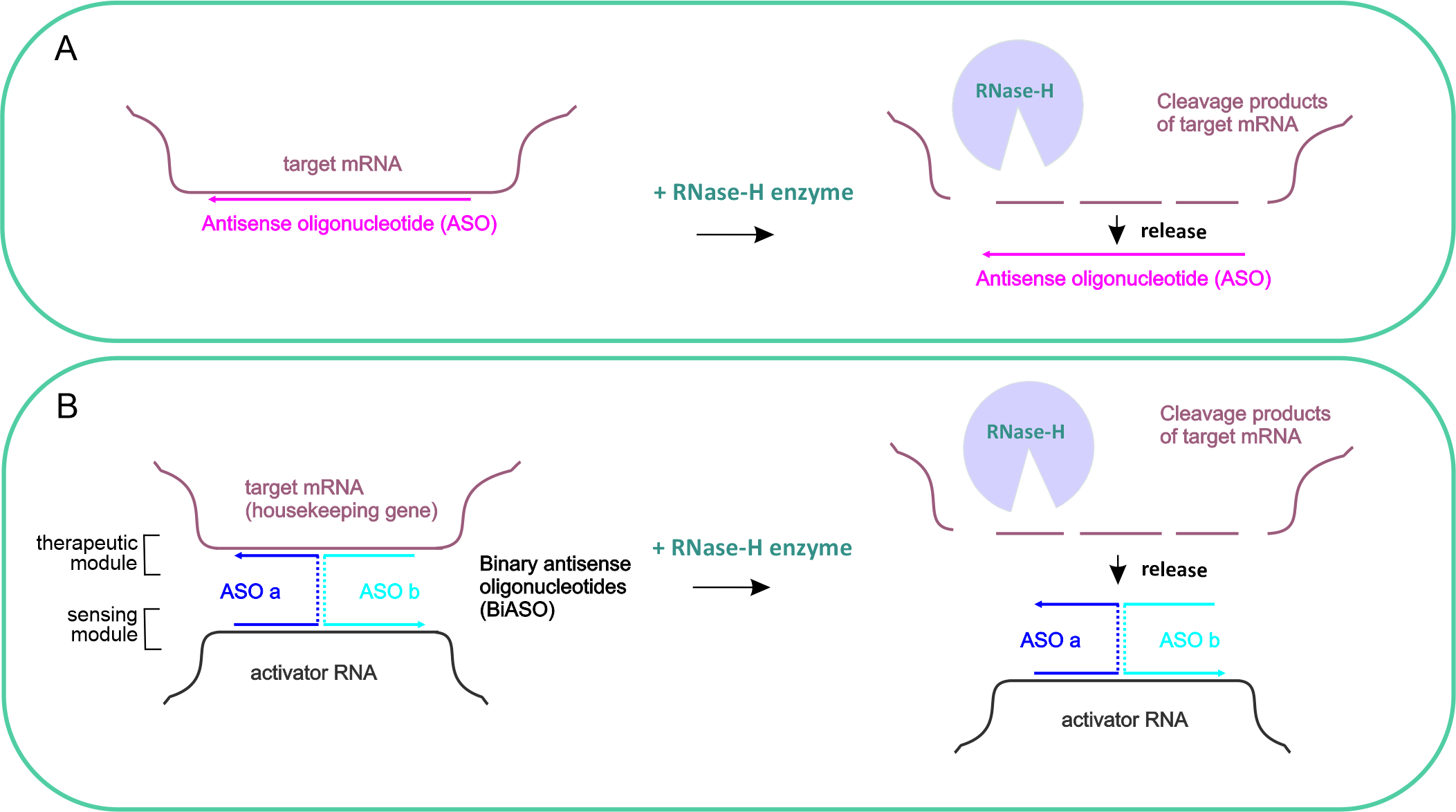
Рисунок 2. Панель А - принцип работы традиционных антисмысловых олигонуклеотидов. Панель B - принцип работы бинарных антисмысловых олигонуклеотидов, имеющих терапевтический и сенсорный модули, активируемых в присутствии онкомаркера
Разработка внутриклеточной доставки и защитных систем олигонуклеотидов
Одними из главных ограничений всех агентов, подавляющих гены, являются неэффективная доставка в раковые клетки и низкая стабильность in vivo. Мы прилагаем усилия для разработки успешных систем внутриклеточной доставки, основанных на рационально сконструированных ДНК-ассоциациях, прикрепленных к биоконъюгатам, таким как фрагменты холестерина (рисунок 3). Чтобы повысить стабильность наших конструкций в физиологических условиях, не влияя на их эффективность и сродство к мишени, мы разрабатываем стратегию химической модификации с использованием подходов gamper и mixmer. Кроме того, мы стремимся уменьшить токсическое воздействие широко используемых химических модификаций in vivo путем разработки специализированных ДНК ассоциаций, которые действуют как системы защиты для наших конструкций. Достигнув этих целей, мы надеемся расширить применение геннотерапевтических агентов в онкотерапии.
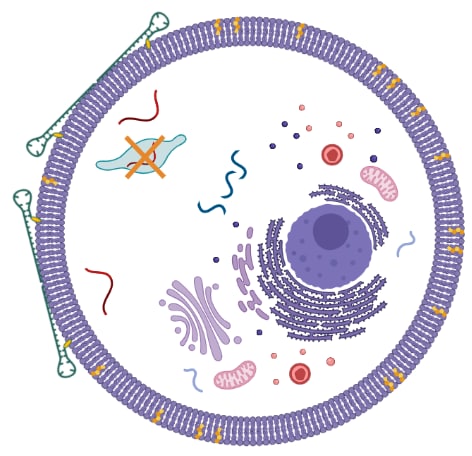
Рисунок 3. Схематическое изображение ДНК-ассоциаций, конъюгированных с холестерином, выпускающих АСО агент во внутриклеточное пространство